La tecnología de proteínas recombinantes, es decir la que permite convertir células en factorías de proteínas o sistemas de expresión, se viene utilizando desde hace décadas en la industria farmacéutica y también en la alimentación. La insulina o enzimas como la quimosina como alternativa al cuajo animal para el queso, son solo algunos ejemplos. Y esos sistemas de expresión pueden ser cualquier tipo de célula, bacterias, levaduras y otros microorganismos -como hemos visto en los casos de Fermentación de Precisión-; células de mamíferos, células de insectos, y también células de plantas. En este último caso hablamos de Agricultura Molecular en Plantas o (PMF por sus siglas en inglés), también denominada horticultura de precisión o proteínas producidas en plantas.
La fermentación de precisión, la agricultura molecular en plantas, representan -actualmente- las plataformas con mayor potencial comercial para expresar proteínas recombinantes. Y se considera ya que la agricultura molecular en plantas representa el cuarto pilar para el desarrollo de proteínas alternativas (junto al plant-based, la carne cultivada y la citada fermentación de precisión). Según GFI, actualmente hay 12 compañías en el campo de la agricultura molecular en plantas, que han capturado 158 millones de dólares en 16 operaciones, entre las destacan Nobell Foods ($100 millones) y Moolec Foods. En este caso, como compradora de la SPAC[1] LightJump Acquisition Corporation, que la convirtió en el primer unicornio y la primera compañía cotizada de la categoría. En España, la extremeña Made in Plants, con tecnología procedente del CSIC, es la pionera de esta industria.
La agricultura molecular en plantas representa el cuarto pilar para el desarrollo de proteínas alternativas
Tabla de contenidos
Qué es la agricultura molecular en plantas
Tal y como nos explica Paloma Juárez, investigadora del centro tecnológico AINIA, [cuando se utiliza para el desarrollo de proteínas animales] “esta técnica consiste en la inserción del gen que codifica la proteína animal de interés (procedente de una base de datos de genes) en el genoma de la planta. Una vez que las plantas son rediseñadas para expresar esa proteína producen semillas, éstas pueden plantarse y cosecharse las plantas resultantes siguiendo el proceso agrícola tradicional”. Prácticamente cualquier vegetal se podría utilizar para el cultivo molecular en plantas, aunque las más usadas actualmente son la soja y otras leguminosas como el guisante, algunas plantas de la familia del tabaco, patatas, lechugas o herbáceas como la alfalfa.
Frente al uso de grandes biorreactores de otras plataformas, en la agricultura molecular en plantas, los vegetales se cultivan en campos, invernaderos o granjas verticales. En este proceso, la planta actúa como un biorreactor de un solo uso que convierte la luz solar, el CO2, el fertilizante y el agua en nutrientes, que las células de la planta utilizan para producir la proteína recombinante deseada. Para recuperar la proteína objetivo –por ejemplo, proteína de cerdo, de vaca, caseína etc.-, se cosecha y procesa el cultivo.
La planta actúa como un biorreactor que convierte la luz solar, el CO2, el fertilizante y el agua en la proteína deseada
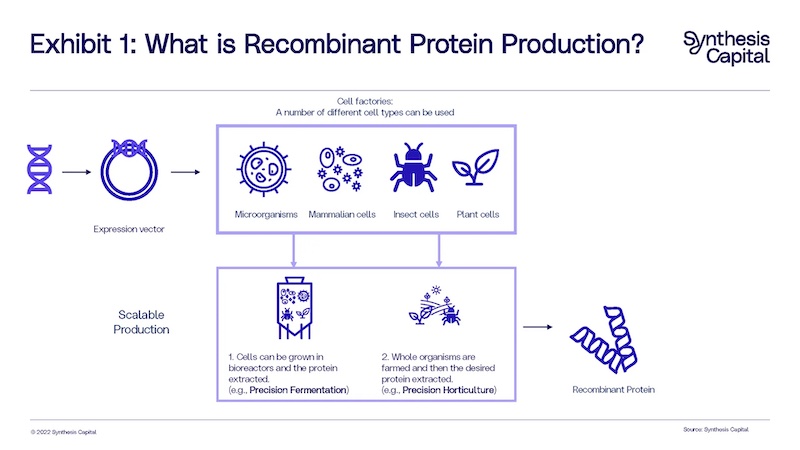
A partir de ahí, los caminos pueden ser diferentes dependiendo del tipo y parte de la planta utilizada para la producción de proteínas (por ejemplo, la hoja de una planta de lechuga o tabaco frente a la semilla de una planta de soja). En casos donde el cultivo ya se está utilizando comercialmente para producir un concentrado de proteínas, como la soja, es posible que el resultado buscado sea una biomasa conjunta (vegetal y animal). En este supuesto, las primeras etapas del procesamiento (como la molienda) serán similares al proceso convencional. Es el caso de Moolec (que veremos en detalle más adelante), cuya plataforma –Piggy Sooy- desarrolla proteínas de cerdo dentro de las semillas de soja y su modelo se basa en la comercialización de esa biomasa conjunta (de proteína vegetal y animal). En otros casos, lo que se busca es la molécula de interés filtrada, por lo que es necesario extraer o aislar la proteína con procesos similares a los utilizados en la fermentación de precisión (por ejemplo, centrifugación o cromatografía).
Qué aplicaciones tiene la agricultura molecular en plantas
Actualmente hay una docena de compañías que están utilizando esta técnica para crear proteínas o moléculas de interés para la industria alimentaria. Además de la citada caseína y proteínas de cerdo y vacuno, se están produciendo proteínas de huevo (ovoalbúmina), quitocinas, enzimas, así como aromas y sabores. Un segmento muy específico es la creación de factores de crecimiento para la industria de carne cultivada. Se trata de una aplicación de alto valor, ya que tiene como objetivo producir una alternativa a los caros y muy cuestionados sueros de origen animal tradicionalmente utilizadas en la industria cell-based.
La startup española Made in Plants ha desarrollado una plataforma de PMF sobre plantas de la familia del tabaco
La industria farmacéutica lleva tiempo trabajado con esta técnica para crear nuevos remedios. Hace algunos años, se experimentó con la incorporación de vacunas en alimentos para facilitar una vacunación masiva en niños de zonas en las que los estos procesos son complejos. “Una idea quizá romántica, pero que el nivel de desarrollo de la técnica entonces no permitió que fuera viable”, explica Paloma Juárez. Sin embargo, los avances en biotecnología sí han permitido aplicaciones médicas concretas. En febrero de 2022, la empresa de biotecnología Medicago obtuvo la aprobación en Canadá para su vacuna contra el COVID-19 Covifenz producida a partir de plantas.
Oportunidad y potencial del cultivo molecular en plantas
A pesar de unos inicios algo desalentadores por la dificultad de lograr una consistencia en la producción y por los costes de procesado, la rápida evolución en biología sintética y edición genética ha permitido mejorar los rendimientos, o niveles de expresión de las proteínas) anteriormente considerados pobres (Moolec Fods logra, por ejemplo, un destacado 26’6%), así como reducir significativamente los costes y plazos de producción. Incluso GFI prevé que podría llegar a ser un 50% más económico comparado con la fermentación de precisión[2], ya que el escalado sería más rápido y menos intensivo en CAPEX.
Una docena de compañías producen así caseína, proteínas de cerdo, vacuno o huevo, quitocinas, enzimas o aromas
De momento, sin embargo, la fermentación de precisión ofrece una ruta más rápida al mercado a corto plazo, ya que los tiempos de reproducción de los microorganismos son mucho más rápidos que las plantas, y con ellos, también los plazos de I+D.
Otros aspectos que juegan a favor de esta técnica son la posibilidad de reconvertir industrias cuestionadas o en recesión, como el tabaco; la posibilidad de generar sub-productos que generen ingresos adicionales a los agricultores; y no menos importante, la percepción del consumidor ya que utilizar un cultivo comestible para producir un ingrediente alimentario tiene un atractivo significativo en comparación con utilizar un microorganismo no comestible para hacer lo mismo.
Uno de los usos más prometedores es el desarrollo de factores de crecimiento para carne cultivada

Retos técnicos y regulatorios
Desde el punto de vista técnico, persisten los desafíos relacionados con el procesado aguas abajo, especialmente debido a los costes asociados a la eliminación de impurezas de las plantas. “Un factor en el que se puede trabajar también desde el mismo diseño de las plantas” nos explica Federico Grau, CEO de Made in Plant, la startup española que ha desarrollado una plataforma sobre plantas de la familia del tabaco.
En cuanto a regulación, el término agricultura molecular no se contempla como tal en la normativa de la UE, aunque se considera incluido dentro de las técnicas de modificación genética y, por tanto, sometido al marco legal en materia de OMG, que data de 2001. Ante los avances científicos y tecnológicos producidos desde entonces, la Comisión publicó el pasado 5 de julio una propuesta que busca aligerar la regulación en dos técnicas concretas: la mutagénesis dirigida y la cisgénesis, para la producción de productos de alimentación y piensos.
La propuesta, todavía pendiente de aprobación, diferencia entre las plantas obtenidas mediante Nuevas Técnicas de Edición Genetica (o NGT, resultantes de métodos de mutagénesis dirigida y cisgénesis, que engloban técnicas como la edición genética o el CRISPR) y las plantas consideradas como transgénicas (u OMG, Organismos Modificados Genéticamente, es decir, variedades que incorporan ADN de especies foráneas). Las NGT, suponen cambios menores en el genoma mediante edición, o la introducción de fragmentos de ADN, pero siempre de plantas o especies del mismo acervo genético o compatibles sexualmente con la planta que se busca mejorar. En la mayoría de los casos, suponen cambios más específicos, precisos y rápidos que las técnicas convencionales, y dan lugar a un cultivo que es igual al que podría haberse logrado con técnicas clásicas, como la selección y el cruce de semillas.
«En el caso de que esta propuesta se apruebe definitivamente, se facilitaría el camino regulatorio para un tipo de agricultura molecular intermedia, que permita mejorar las plantas, por ejemplo, para aumentar el contenido nutricional de algunos alimentos (biofortificación)», nos explica Diego Orzáez, investigador del Insituto de Biología Molecular y Celular de Plantas (UPV-CSIC) y uno de los impulsores de Madeinplant. «O también para preparar una planta y mejorar sus capacidades como biofactoría -antes de alojar el factor recombinante o material genético externo-, lo que daría lugar a una nueva industria muy interesante.» Sin embargo, si el material genético a introducir procede de organismos alejados a la planta –de origen animal, por ejemplo- estas técnicas seguirán estando sometidas a la regulación OMG de la UE.
La industria seleccionará la plataforma más adecuada según escalabilidad, costo, impacto en la funcionalidad del producto final, apertura regulatoria y rapidez de entrada al mercado.
Otro aspecto a tener en cuenta está relacionado con la bioseguridad ambiental. En este caso, es importante diferenciar aquellos cultivos que se desarrollan en entornos controlados -por ejemplo un invernadero certificado con determinadas condiciones de confinamiento– de aquellos que pretenden desarrollarse a campo abierto. Mientras que en el primer supuesto, las condiciones regulatorias son semejantes a las que se aplican a técnicas como la Fermentación de Precisión; en el segundo, el campo abierto, la regulación europea es mucho más restrictiva que regiones como Lationoamérica o EEUU, lo que dificulta el desarrollo de este tipo de iniciativas en suelo europeo.
A falta de aprobación y de concretar detalles de aplicación, el sector da la bienvenida a una actualización de la regulación que diferencia NGTs y OMGs, no solo porque facilitará la innovación, sino también porque ayudará a rebajar la percepción negativa de la modificación genética. AseBio (As. Española de Biotecnología) considera que «es un paso adelante para facilitar la aprobación de productos obtenidos mediante NGTs, en base a una evaluación de la seguridad basada en las características de la planta final, no de la tecnología utilizada para su obtención».
El cuarto pilar de las proteínas alternativas
En un contexto de crecimiento del mercado de las proteínas recombinantes para aplicaciones alimentarias, la agricultura molecular se suma a la fermentación y otras técnicas como el cultivo celular animal o las diferentes técnicas plant-based para aumentar las opciones en el desarrollo de alimentos alternativos o complementarios de los de origen animal. ¿Cuál triunfará? La opinión generalizada es que no habrá una única plataforma tecnológica utilizada para producir todos los análogos de carne, huevo y lácteos. “Más bien -como explica Catherine Tubb, directora de investigación de Syntesis Capital, uno de los fondos con inversiones en esta categoría- la industria seleccionará la plataforma más adecuada para una proteína determinada en función de la escalabilidad, el costo, el impacto en la funcionalidad del producto final, la apertura regulatoria y la rapidez de entrada al mercado en cada mercado objetivo.» «El uso de las plantas, definitivamente, es una cuestión de tiempo que todos lo consideren. No tengo duda de que esto va a pasar”, afirma Gastón Paladini, CEO y co-fundador de Moolec Foods.
Cuatro ejemplos de agricultura molecular en plantas
Moolec Foods. Proteína de cerdo en semillas de soja
Moolec Foods no es una startup al uso. Es un proyecto de innovación surgida de una visión de cambio de ciclo que reúne al líder argentino en carnes y fiambres (Grupo Paladini, que cuenta con un 23% de cuota de mercado) y al fabricante de semillas Bioceres Crop Solutions, a través de su brazo inversor, Bioceres Group, del que Moolec Foods es una spin-off liderada por su co-fundador y CEO, Gastón Paladini, con más de 20 años de experiencia en la industria tradicional como director del grupo familiar. “Como productores de proteína animal, éramos conscientes de que teníamos que afrontar de alguna forma cuatro problemas: la presión medioambiental, tanto administrativa como del propio consumidor; la dificultad de cuidar la salud de los animales en la industria intensiva; la ineficiencia de la ratio de conversión de proteína vegetal a animal; y una creciente conciencia sobre el bienestar animal”.

Tras su sonada operación a principios de año con LightJump Acquisition Corporation – que la convirtió en el primer unicornio de la categoría– Moolec Foods presentó en junio Piggy Sooy, la plataforma para desarrollar proteínas de cerdo en soja. Con ella, han logrado un muy alto nivel de expresión de proteínas, con un procedimiento patentado que llega al 26’6% de la proteína soluble. Mayor que ninguna compañía hasta ahora y cuatro veces lo proyectado inicialmente por la compañía. El resultado puede verse a simple vista en el color rosado que adquieren las semillas de soja obtenidas con este procedimiento. Y no es cuestión únicamente de volumen de proteínas, importa también el aporte en términos de valor nutricional, propiedades organolépticas (aroma, sabor y textura) y funcionalidades (como el aglutinamiento o la retención) que lleva consigo la proteína animal. “Nuestro producto final es una soja fortalecida y enriquecida con proteína animal. Porque nuestro cliente -el fabricante de productos cárnicos, híbridos o plant-based- necesita las dos. Y con nuestro ingrediente tendrá que poner menos carne y aditivos”, explica Gastón Paladini. El mercado al que se dirige la compañía argentina es el de los procesados cárnicos, que supera los 600.000 millones de dólares.
Nuestro producto final es una soja fortalecida y enriquecida con proteína animal. Porque nuestro cliente -el fabricante de productos cárnicos, híbridos o plant-based- necesita las dos.
El de Moolec Foods, es un ejemplo de la fórmula de “biomasa conjunta” antes explicada, y que es la apuesta clave de Moolec para lograr un proceso rápido y viable y un producto asequible y manejable con procesos ya existentes e industrialmente escalables. Dados los condicionantes regulatorios, la startup argentina apuesta por iniciar sus operaciones en los mercados más amables con los cultivos y productos GMO: EEUU, Latinoamérica y Asia.
Made in Plant
Con origen en Extremadura, Made in Plant nace a partir de tres grupos de investigación en biotecnología del CSIC. La startup se ha especializado en la generación de biomoléculas recombinantes de alto valor mediante plantas pertenecientes a la familia del tabaco, un cultivo de importancia histórica en la región.
Made in Plant ha identificado en las plantas de tabaco un «chasis» idóneo para la manipulación genética y la síntesis de biomoléculas por las propiedades inherentes de estas plantas que las hacen propicias para la ingeniería genética y facilitan su adaptación para generar moléculas específicas.
La plataforma central de Made in Plant, denominada Golden Brain Tech, cuenta con una amplia biblioteca de más de mil piezas de ADN y un conjunto de herramientas genéticas, “esta plataforma actúa como una suerte de «Lego genético», con el que dar instrucciones genéticas a las plantas y lograr que produzcan las biomoléculas de interés”, explica Federico Grau, CEO de Made in Plant. “Esta metodología modular, semejante a los estándares de ingeniería, nos permite la generar prototipos sofisticados de manera muy ágil.”
Made in Plant cuenta con tecnología protegida para reducir los costes en la fase posterior de producción
Un elemento fundamental de su tecnología protegida es el enfoque empleado en la elaboración de prototipos, uno de cuyos objetivos el objetivo de reducir los gastos en la fase posterior de producción.
En la actualidad, Made in Plant concentra sus esfuerzos en la producción de biomoléculas de alto valor, como factores de crecimiento para la industria cell-based. Mediante sistemas de cultivo en interiores altamente controlados, la empresa persigue mantener la uniformidad en la producción de proteínas, contrarrestando las variabilidades asociadas al cultivo al aire libre. Este acercamiento no solo garantiza la calidad y la pureza del producto final, sino que también allana el terreno para futuras implementaciones de esta tecnología en el ámbito al aire libre.
BioBetter
La startup israelí BioBetter, también ha desarrollado una plataforma de fabricación de proteínas para producir factores de crecimiento (GFs) utilizando plantas de tabaco como biorreactores. Precisamente, acaba de anunciar la apertura de su su primera instalación piloto de grado alimentario para acelerar la producción de estos elementos clave para la industria de la carne cultivada. Estos bioreactores vegetales, que se cultivarán en un sistema en invernaderos a gran escala, son inducidos a expresar factores de crecimiento de grado alimentario, incluyendo FGF2[3] e insulina. Cuenta ya con varios miles de metros cuadrados de instalaciones en el norte de Israel, donde cultiva plantas de tabaco no destinadas a la alimentación con el objetivo de eliminar cualquier riesgo de consumo involuntario o contaminación cruzada de cultivos alimentarios.
GFI prevé que podría llegar a ser un 50% más económico comparado con la fermentación de precisión
La planta piloto recién establecida tiene la capacidad de procesar 100 kg de GFs derivados de plantas de tabaco al día, aunque el objetivo de BioBetter en una siguiente fase es procesar 25 toneladas de hojas al día, y alcanzar una producción comercial de cinco toneladas anuales para finales de 2025. «Nuestro objetivo es reducir el costo de producción de factores de crecimiento, incluyendo la insulina, una parte fundamental del medio de crecimiento, a 1 dólar por gramo, lo que representa una reducción de 100 veces en comparación con la tarifa actual«, explica Amit Yaari, CEO of BioBetter. La compañía, de 50 empleados, ha realizado ya varias pruebas de concepto con empresas de carne culitvada y laboratorios académicos “con resultados prometedores”. Además está trabajando en la expresión de insulina bovina.
Nobell Foods
Nobell Foods se ha especializado en la producción en plantas caseína, una proteína funcional presente en la leche. Esta molécula es la responsable de las cualidades más características del queso como el fundido, o la elasticidad. Nobell Foods utiliza la soja como plataforma para producir caseína. Estas leguminosas ya se caracterizan por desarrollar un alto contenido de proteínas (entre el 36 y el 43 por ciento en total) y son fácilmente escalables debido a la infraestructura existente para su cultivo.
«Estamos aprovechando el cultivo de proteína más eficiente del planeta», esto nos permitirá, a largo plazo, competir con las proteínas animales que se comercializan como comodities”, explica Magi Richani fundadora de Nobell Foods.
Para transformar verdaderamente la industria, es necesario crear toda la cadena de suministro, y los agricultores deben formar parte de la ecuación

La compañía trabaja con agricultores que están adoptando el cultivo de la nueva soja, mientras simultáneamente desarrolla recetas para sus primeros quesos elaborados con este ingrediente. «Para transformar verdaderamente la industria láctea, es necesario crear toda la cadena de suministro, y los agricultores deben formar parte de la ecuación. Brindarles opciones para cultivar cultivos especializados como el nuestro les ofrece nuevas oportunidades económicas».
Nobell ha captado $100 millones en inversiones hasta la fecha, respaldo de fondos como Andreessen Horowitz, AgFunder, o los vehículos de personalidades como Bill Gates y el actor Robert Downey Jr.
Mozza Foods
Mozza Foods, con sede en California, ha patentado un sistema para formar micelas de caseína dentro de las factorías vegetales. Aunque más desafiante desde el punto de vista de la biología molecular, esta estrategia tiene el potencial de simplificar la producción (una planta en lugar de varias) y la purificación posterior (las micelas de caseína son un orden de magnitud más grandes que las proteínas de caseína individuales y, por lo tanto, más fáciles de purificar), lo que permite una producción de micelas de caseína a menor costo.
Como su nombre sugiere, la estrategia de la startup apunta hacia la caseína de mozzarella, ya que la estructura de este queso fresco es más simple, pero también porque es una industria global de casi 50 mil millones de dólares. Aunque la caseína que desarrolla Mozza puede aplicarse a la producción de cualquier tipo de queso, la compañía apuntará al mercado de la mozzarella en los Estados Unidos, que actualmente tiene un valor de alrededor de 10 mil millones de dólares (casi el 10% del queso consumido se utiliza como cobertura de pizza).
[1] https://www.eleconomista.es/mercados-cotizaciones/noticias/10664507/07/20/Que-son-las-SPAC-la-nueva-moda-para-salir-a-bolsa-en-EEUU.html
[2] Esto fue respaldado por un estudio de 2016 que evaluó la tecnología-economía de la producción de anticuerpos monoclonales a través de plantas. Al mejorar los niveles de expresión de proteínas y optimizar la purificación aguas abajo, el modelo predijo una reducción del 50% en el costo de los productos en comparación con los valores publicados para la fermentación de precisión.
[3] Un factor de crecimiento de fibroblastos o FCF es un factor de crecimiento que aumenta el índice de actividad mitótica y síntesis de ADN facilitando la proliferación de varias células precursoras. Esta familia de factores de crecimiento1contiene más de 20 miembros, de los cuales FCF ácido (aFCF o FCF-1) y FCF básico (bFCF o FCF-2) son los mejor caracterizados https://es.wikipedia.org/wiki/Factor_de_crecimiento_de_fibroblastos

Una respuesta en esta entrada.